冬の道路 塩をまいたら凍らない!
冬の道路は雨や雪が降ると凍りやすくなり、人の転倒事故や車のスリップ事故を招いて、とても危険です。でも、道路に塩をまくと、凍らなくなります。なぜでしょう? その理由は、「凝固点降下」という現象にあります。水が氷になる凝固点(液体が固体に変化する温度)は0℃ですが、水に塩を溶かした塩水の凝固点は0℃よりも低くなります。これを「凝固点降下」といいます。
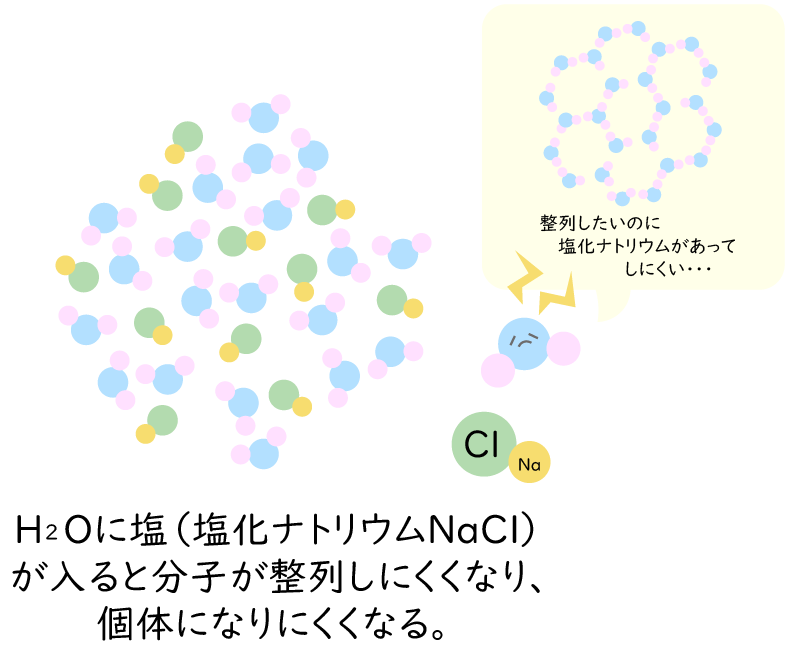
水は水分子でできていますが、気温や圧力の変化によって固体(氷)、液体(水)、気体(水蒸気)の状態に変化します(物質の三態)。純水で作った氷は、水の分子が規則正しく並んでいます。しかし、水の中に別の物質の分子が入り込むと、水の分子が整列しにくくなるため、なかなか氷になることができません。このため、水の中に塩が入った塩水は、氷にならずに塩水のままで0℃以下に温度が下がっていくのです。塩水は、濃度が高くなるとともに凝固点降下が大きくなり、濃い塩水はマイナス20℃くらいまで、飽和食塩水(水に食塩が限界まで溶けた状態の水溶液)になるとマイナス21.3℃まで凍りません。
一般的に使われる凍結防止剤の成分は塩化ナトリウム(NaCl)ですが、一部の地域では塩化カルシウム(CaCl2)が使われることもあります。塩化カルシウムは塩素とカルシウムの化合物です。それぞれを水溶液にした場合の凝固点は、塩化ナトリウムが濃度23.3%で約マイナス21℃なのに対し、塩化カルシウムは濃度32%で約マイナス51℃となります。マイナス51℃まで凍らないので、特に雪の多い寒い地域には向いています。
ところで、雪道の安全走行に欠かせない凍結防止剤ですが、車が錆びる原因にもなります。鉄は水分が付着すると酸化して錆びやすくなりますが、塩化ナトリウムや塩化カルシウムなどを含んだ水分は、さらに金属の腐食を速めてしまいますので、注意が必要です。
